نظرسنجی
یادداشت های مهم
همهابر برچسب
مدیریت زمان مجله تهویه مطبوع،تهویه مطبوع آزمون مبانی مهندسی حرفه ای روش مدیریت زمان روش های مدیریت زمان کنکور دکتری مصاحبه با رتبه برتر کنکور ارشد تمرکز برای کنکور تمرکز در مطالعه قانون پارکینسون مصاحبه با نفرات برتر کنکور ارشد ختم قرآن/رمضان 94 ختم قرآن/قرآن/ماه رمضان/رمضان خودرو کتاب ویل دورانت لذات فلسفه ویل دورانت لذت فلسفه لذات فلسفه انرژی های تجدید پذیر مهندسی مکانیکجدیدترین یادداشتها
همه- خداحافظ
- تولدت مبارک عسل بانو
- فیلم آموزش نصب کولر اسپیلت .(زبان اصلی)
- معرفی فیلم pk
- مشکل کمبود آب برطرف شد :) واقعا !!!
- ختم قرآن عربی/فارسی رمضان 94
- یه روزی به گوشت میرسه!"
- رضایت/نعمت/ترس
- یادگیری نرم افزار کریر و شروع کار تاسیسات
- افزایش رطوبت ،کاهش دما
- محصولات چینی در زمینه انرژی خورشیدی+++
- فیلم دیگ چدنی
- یار دوازدهم کی .....
- نظر سنجی ختم قرآن /هخامنش عزیز
- مقاله cfd
- رتبه ها و درصد ها
- سنگفرش هر خیابان از طلاست
- انگشترم / هخامنش
- دانلود مجموعه آهنگهای بی کلام رویاهای عاشقانه
- توجه در نماز !
بایگانی
- تیر 1396 1
- تیر 1394 4
- خرداد 1394 10
- اردیبهشت 1394 8
- فروردین 1394 23
- اسفند 1393 8
- آذر 1393 1
- آبان 1393 4
- مهر 1393 3
- شهریور 1393 10
- مرداد 1393 29
- تیر 1393 16
- خرداد 1393 6
- اردیبهشت 1393 24
- فروردین 1393 23
- اسفند 1392 24
- بهمن 1392 9
- دی 1392 9
- آذر 1392 6
- آبان 1392 6
- مهر 1392 7
- شهریور 1392 25
- مرداد 1392 77
- تیر 1392 50
- خرداد 1392 38
- اردیبهشت 1392 3
- بهمن 1391 25
- دی 1391 5
- آذر 1391 7
- آبان 1391 10
- مهر 1391 2
- شهریور 1391 20
- مرداد 1391 23
- تیر 1391 6
- خرداد 1391 10
- اردیبهشت 1391 38
- فروردین 1391 9
- اسفند 1390 36
- بهمن 1390 5
- دی 1390 5
- آذر 1390 7
- آبان 1390 5
- مهر 1390 6
- شهریور 1390 15
- مرداد 1390 20
- تیر 1390 6
- خرداد 1390 5
- اسفند 1389 1
- بهمن 1389 2
- آذر 1389 1
- مهر 1389 1
- شهریور 1389 7
- مرداد 1389 22
- خرداد 1389 1
- فروردین 1389 8
- دی 1388 1
- آذر 1388 1
- آبان 1388 1
- مهر 1388 1
جستجو
ارایه مثال برای نامساوی کلازیوس و اهمیت آن
پیرو پست ارایه مثال برای نامساوی کلازیوس و اهمیت آن
مهلت پاسخگویی:92/05/22
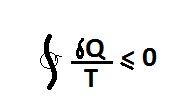
یک فنجون چای داغ رو مثال میزنیم :
وقتی چای داغ هست مثلا 90 درجه سلسیوس هست و در اتاق 25 درجه قرار میگیره آروم آروم سرد میشه تا به تعادل دمایی با محیط میرسه و دماش میشه 25 درجه سلسیوس .
خوب اگر بخوایم سیکل بشه تا انتگرال سیکلی بگیریم براش باید دوباره چای رو داغ کنیم تا مجددا به دمای 90 برسه و عینا به حالت مشابه اولیش برسه.
خوب برای اینکار 2 راه میتونیم داشته باشیم:
1-فنجون رو بذاریم رو شعله و گرم کنیم تا از 25 مجددا به 90 برسه و بعد شعله رو خاموش کنیم(یا مثلا یه المنت برقی بذاریم توی فنجون و...)در حین گرم کردن باید کل جداره فنجون رو با پشم شیشه عایق کنیم همچنین باید رو سر فنجون رو هم با مثلا یک نعلبکی بپوشونیم و خود نعلبکی هم با پشم شیشه عایق شه
اما در این حالت در حین گرم کردن و سرمایش(هر دو) کل جداره فنجون رو با پشم شیشه عایق کنیم همچنین باید رو سر فنجون رو هم با مثلا یک نعلبکی بپوشونیم و خود نعلبکی هم با پشم شیشه عایق شه
سیکل شماره یک بازگشت ناپذیر و سیکل دومی بازگشت پذیر هستن.
در مورد دوم "تمام مایع" موجود در فنجون به میزان dT دماشون بالا میره تا آرام آرام از 25 به 90 برسه یعنی مثلا ابتدا "کل مایع چای " میشه 25+dT سپس میشه 25+2dT و....
خب انتگرال سیکلی کلازیوس رو اگر اعمال کنیم برای این سیکل داریم:
m جرم کل مایع چای هست
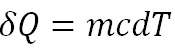
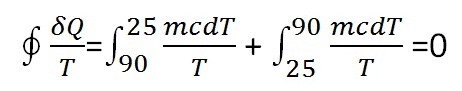
و عقلا درست هم هست چون جای کران بالا و پایین انتگرالا با هم عوض شده.
از دو ترم بالا کدوم منفی و کدوم مثبته؟
اما داستان اینجاست که اگر به شیوه شماره 1 عمل کنیم انتگرال سیکلی کلازیوس منفی میشه.
یعنی مجموع Q/T های سرد شدن چای بیشتر از Q/T های گرم شدن چای هست.
کسی میتونه توضیح بده؟
جوری توضیح بدید که بشه تو یک کتاب علمی آوردش
هر کسی بتونه توضیح بده اسمشو تو کتابی که دارم مینویسم میآرم.

1.اگه اونو سیستم در نظر گرفت و فنجون چای دورتر از شعله باشه چون دیرتر دما اضافه م
یشه و آروم آروم است گمون تولید انتروپی و تولید انرژی داخلی داریم و میشه برگشت ناپذیر
2.اگه نزدیگ شعله باشه چون فاصله کمه زودتر دما اضافه میشه و گرما سریعتر منتقل میشه میشه فرض کردی انتروپی مساوی صفر همچنین انرژی داخلی پس نتیجتا میشه برگشت پذیر
انشلا توضیح خوبی باشه اینم آخه برق رفته اینجا نشتم بیرون و فکر کردم با گوشیم نظر دادم دیگه همین قدر بلد بدوم انشلا کمی درست باشه اگه هم غلطه بهم توضیح بده؟
کاملا برعکس گفتید برادر
یه بار دیگه متنو با دقت بخون
خوب برعکسشو قبول کن دیگه ؟ بازم ممنون
باشه برعکسش قبول ولی ما سؤال کردیم چرا منفی میشه؟
من سیالاتم ولی به نظرم مهندسی مکانیک یعنی دینامیک و ترمودینامیک
ممنون
به نظر من مهندسی مکانیک یعنی همه درسا استاتیک بگیر تا آخریش....اما مهم اینه که دانشجو رو زده نکنن با این کنکورای غیر استاندارد وگرنه مقاومتش هم در جای خودش قشنگه ...
سلام
من تازه این پستو دیدم لطفا یه کم وقت بیشتری بدین روش فکر کنم .
سلام
اکی
سلام مهندس

آقا ما فکر کردیم نتیجه نداد . ادامه بده !
راستش ت حالت چون کل چای به دمای T+dTمیرسه از طرفی dT هم واقعا دیفرانسیلیه ! پس انتگرال ما مثل آدم! صفر میشه .
تو حالت دوم دوتا فرق داره اول این که dT نداریم و دلتا T داریم یعنی اختلاف دمای گرم کن و آب اطرافش زیاده . دوم این که همه ی آب تو یه دما نیستن یعنی اطراف گرم که - مرز گرمکن - تو دمای گرمکنه - مثلا 90 درجه - و ته فنجون تو دمای 25 درجه پس نمیشه مثل آدم انتگرال گرفت و دیفرانسیل ما ناقصه یعنی علاوه بر دما مکان هم مهمه . حالا این که از این چجوری انتگرال میگیرن نمیدونم . شاید چای رو به بینهایت ناحیه ی دایه شکل اطراف گرمکن تقسیم کنیم که دما تو هر ناحیه ثابته و بعد با روش های عددی انتگرال بگیریم . البته این توضیحات بیشتر ریاضی بود اگر منظور شما بعد فیزیکی مسئلست که خیلی پرت شدم !
سلام
جدا ممنون از دقت نظرت
توضیحاتی که دادی درستن اما یه نکته فیزیکی رو هم باید لحاظ کنی توشون که جواب نهاییت بدست بیاد حالا زیاد خودتو اذیت نکن همینقدر هم عالیه
جوابو میگم بعد از 22 ام مرداد به زودی انشالّله
گفتی جوابم درسته جراتم بیشتر شده !
فکر کنم شرط فیزیکی اینه که Q در دو حالت باید برابر باشه .
نه اتفاقا درست بر عکس Q در دو حالت یکی نیستن...و رمز کشف جواب همینجاست
یه سوال دارم
این که میگید دوباره به دمای 90 درجه میرسونیم یعنی چی ؟
یعنی دماسنج رو میذارید وسط مایع یا دمای میانگین می گیرید یا با یه همزن مایع رو هم میزنیدبعد اندازه میگیرید ؟
خیلی داری نزدیک میشی
فهمیدم مرادت از این سؤال چیه
چون فکر میکنی که در حالت برگشت ناپذیر مایع نزدیکتر به شعله در دمای بیشتر و مایع دورتر در دمای کمتر به سر میبره این سؤال پیش اومد برات...
نه منظور زمانی هست که کل مایع به دمای 90 میرسن حالا شما واسه راحتی کار فرض کن بگیم به دمای 100(یا همون 96.6) میرسن یعنی زمانی که مایع به جوش میآد
خوب دیگه در اون لحظه میتونیم مطمئن باشیم که کل مایع در یک دما هست دیگه نه؟ :)